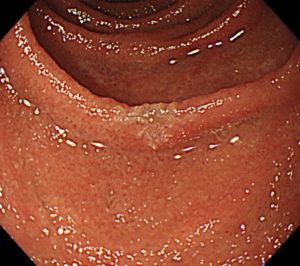
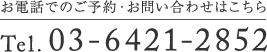食道潰瘍(非腫瘍性、非逆流性食道潰瘍)③(胃内視鏡/胃カメラ)
食道潰瘍をきたす薬剤としては、抗菌薬、解熱鎮痛薬(NSAIDS)、徐放性カリウム製剤、ビスホスホネート、ダビガドラン、オセルタミビルなどが報告されています。
小潰瘍が多発集簇している内視鏡像の場合、ウィルスやクローン病などによるものの他、薬剤による潰瘍を鑑別する必要があります。
写真の症例は、当院で経験された解熱鎮痛薬による薬剤性潰瘍です。
薬剤性食道潰瘍の予防のためには、一般に十分量の水で服用するとともに、すぐに臥位をとらないようすることが大切です。
監修 院長 岡田 和久
食道潰瘍(非腫瘍性、非逆流性食道潰瘍)②(胃内視鏡/胃カメラ)
当院で経験された非逆流性の食道潰瘍に、たこ焼きによる食道熱傷があります。
写真の症例では、咽喉頭に発赤がみられ、食道の生理的狭窄部(食道と気管支が近接する部位)に潰瘍がみられたため、食事による熱傷の可能性が鑑別されました。
熱傷による食道潰瘍は、原因となる出来事から数日経ってから胸焼け、心窩部痛、つかえ感、発熱などの症状が生じることがあるため、患者さん自身が原因を自覚しないことがあり、数日に遡って食事歴を聴取する必要があります。
日頃経験されるように、たこ焼きは外部と内部にかなり温度差があるため、外部がそれほど熱くなくても食べてみたら口の中で高温であることがあり、出来立てのたこ焼き内部の温度は100度以上になっています。また成分的に粘性が高いことから、嚥下しても食道内に停滞しやすく、消化管に熱傷をきたし易いとされています。たこ焼きによる食道熱傷は、クリニックなどでたまに経験される事象ですが、熱傷範囲が広範であっても比較的傷が浅いことが多いため、ほとんどの場合数日で症状は消失し、瘢痕・狭窄などを残さずに治癒します。
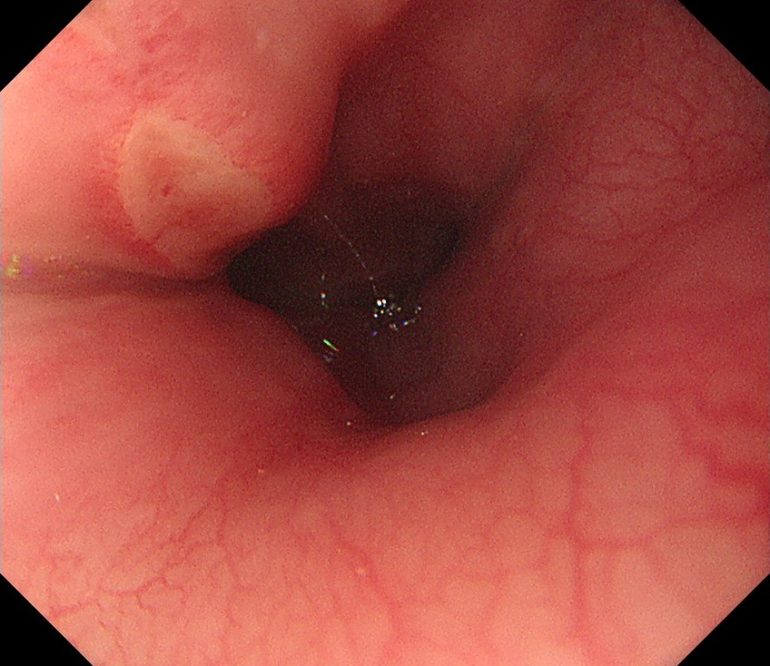
食道潰瘍(非腫瘍性、非逆流性食道潰瘍)①(胃内視鏡/胃カメラ)
潰瘍とは、病理学的に深い傷のことをいい、浅い傷はびらんと呼びます。
食道潰瘍で多い原因は、胃酸逆流による逆流性食道炎に伴うものです。この場合、多くは胃と食道のつなぎ目から連続的な炎症がみられるので、診断は比較的容易です。原因の多くは胃液が食道内に逆流、停滞することで、制酸薬などを適切に使用することにより治癒が得られます。
食道の潰瘍にはその他に、内服した薬剤(抗菌薬、解熱鎮痛薬、抗凝固薬)などが食道内に停滞し化学的な炎症が惹起されることにより生じる薬剤性食道炎や、強酸や強アルカリなどの腐食性薬剤・腐食洗剤の服用(誤飲)による腐食性食道炎、ヘルペスウイルスやサイトメガロウイルス感染に伴う潰瘍などがあります。
薬剤性食道炎は、薬の内服に際して十分な水分をとらなかったり、内服直後に横になるなどして、薬剤が食道内に停滞することが原因とされますが、食道の運動機能低下によっても生じえます。腐食性食道炎は、洗剤や漂白剤などの腐食薬剤が原因で、小児では誤飲、成人では自殺目的によるものが大半を占めています。腐食作用のある薬剤だけでなく、時に多量の熱湯を飲むことでも同様の病態となりえます。腐食性食道炎は広範囲に潰瘍が広がる場合が多く、治療に難渋する上、治癒とともに潰瘍の瘢痕が狭窄して食べ物の通りが悪くなる上、瘢痕部から癌が発生することがあり、手術で食道全摘を余儀なくされる例もあります。ウイルス性食道炎では、真菌や特殊なウイルス感染が原因となり、背景として時に免疫力の低下がみられることがあります。
胃アニサキス症③(胃内視鏡/胃カメラ)
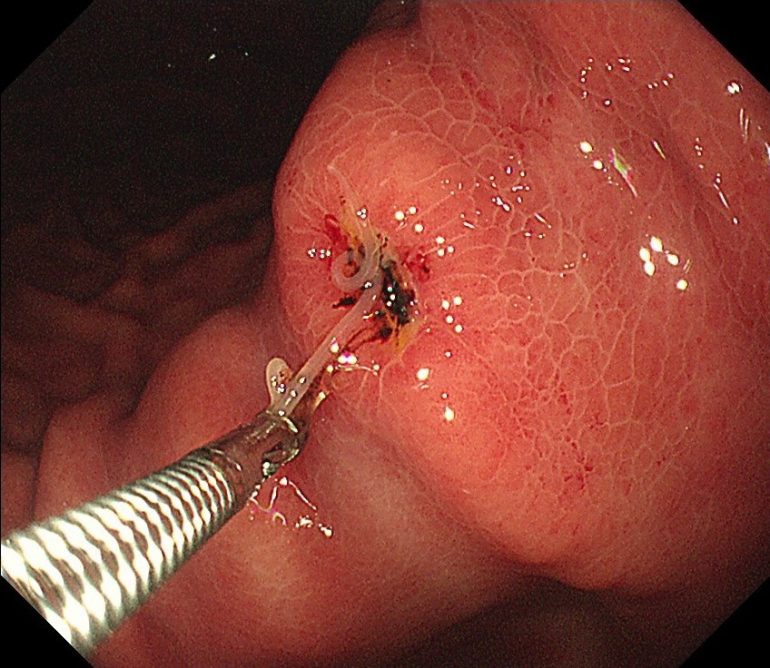
アニサキスが胃壁に刺入した部位には、局所の反応として、前回➁の写真で示したびらん・潰瘍などが形成されます。
しかし肉芽腫の形成が顕著となった場合、粘膜下腫瘍となり、GISTなど手術が必要な他の粘膜下腫瘍と鑑別を要します。
この粘膜下腫瘍の形成には、強い腹痛や嘔気といったアニサキスによる顕著な腹部症状がなくとも生じうることに加え、時に頂部にびらん、小潰瘍を伴っている場合があり、これが悪性度の高いGISTの所見と類似することから、しばしば鑑別が困難なときがありますが、アニサキスによって生じた粘膜下膨隆は、他の粘膜下腫瘍と異なり、経時的に徐々に縮小・減退していくことなどから診断できます。この粘膜下腫瘍は、発見時から数か月後には消失するため、vanishing tumorとも呼ばれています。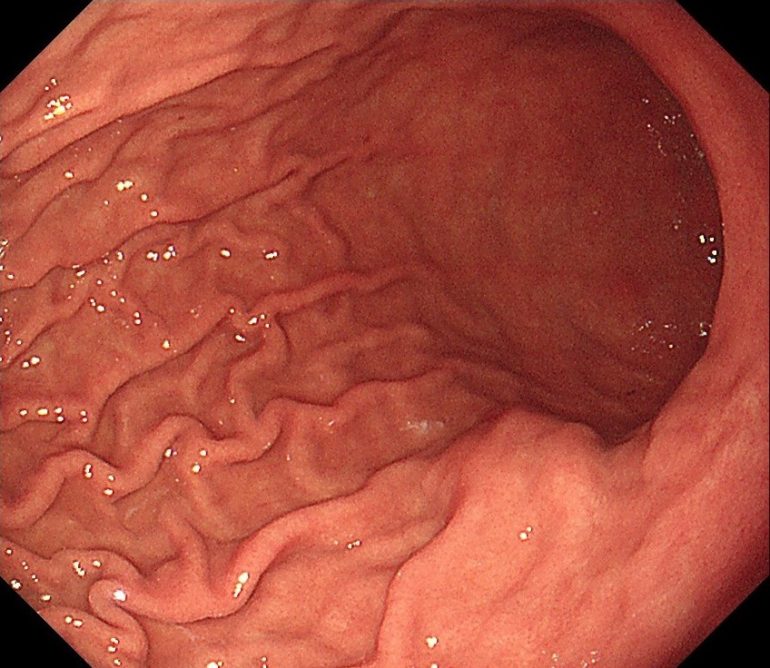
胃アニサキス症②(胃内視鏡/胃カメラ)
胃アニサキス症は、魚類を摂取してから数時間に発現する、強い腹痛や嘔気などが特徴です。アニサキスが刺入している胃粘膜には病理学的に好酸球の増多がみられ、発症した患者に血清アニサキス特異的IgE抗体の上昇がみられることから、発症機序は、アニサキスに対するⅠ型アレルギーであると理解されています。逆に、アレルギーを持たない方は、アニサキスが刺入しても顕著な症状を呈さない場合があります。また、魚類摂取後に生じる蕁麻疹の大部分についても、アニサキスに対するアレルギーに起因するとの考え方が主流となっています。
自由ヶ丘消化器・内視鏡クリニック
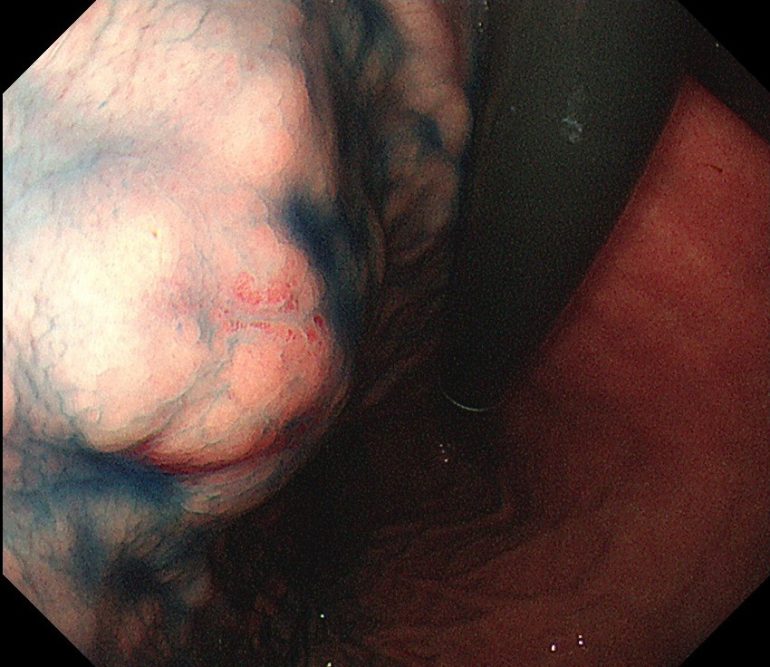
胃アニサキス症①(胃内視鏡/胃カメラ)
食中毒症で有名なものにアニサキス症があります。
アニサキスとは、魚や鯨の体内に生息している寄生虫をいいます。その幼虫はオキアミを経てサバ、アジ、イワシ、イカ、サバ、サケ、ニシン、スルメイカ、サンマ、ホッケ、タラ、マス、ハマチ、ブリ、カツオなど様々な魚に寄生し感染幼虫になります。そして人がアニサキスに感染した魚を生で食べることで、食中毒(アニサキス症)が発症します。
アニサキスが摂取されると、胃、十二指腸、小腸などの壁に侵入し、多くが2-8時間後に、時に激しい間欠的な腹痛や嘔気などの症状を引き起こします。これらの症状は、胃潰瘍などの他の胃腸疾患の症状と似ているため、患者さんからの食事歴の申告や、医師の問診が診断に重要となります。アニサキスは、人の体内では長く生きられないため、多くは1週間以内には死ぬとされています。そのため、腹痛などの症状がでても自然によくはなりますが、強い症状が持続的に続く場合には、虫体を内視鏡的に除去するなどの治療介入が必要となります。内服薬としては、制酸薬に加え抗炎症作用、抗アレルギーのある薬剤(ステロイドなど)の投与が、症状緩和に期待できます。
ところで、アニサキスは魚の内臓に寄生し、魚が死ぬとはじめて筋肉内へと移動していきます。そのため、心得ている釣り人の方ならば、魚を釣り上げて1時間以内に魚を捌き内臓を取り除く処置をしており、そうすることで刺身を食べたときに感染することを防ぐことができます。
自分でできる予防策としては、感染源である寄生している魚を知り食べる前によく観察すること、熱処理(60℃の熱で1分以上過熱)、よく噛んで食べることなどが言われています。
十二指腸腺腫/十二指腸がん③(胃内視鏡/胃カメラ)
進行した十二指腸がんの外科手術は大きな侵襲を伴うため、その前段階である腺腫のうちに早期発見し、内視鏡で切除・治療することほうが患者さんにとってメリットがあります。しかし低侵襲とされる内視鏡治療でも、他の臓器に対する内視鏡治療に比べて合併症(穿孔・術後出血)が高いとされており、それらの合併症は他臓器の治療後合併症に比べてより重篤になりやすいことが報告されています。これは、十二指腸壁がうすいことによる損傷のされやすさ、管腔が狭いことによる内視鏡治療時の操作困難性に加え、胆汁・膵液の流出口が十二指腸に開口しているために治療後の潰瘍が消化されやすことなどが原因とされています。
最近、従来の切除方法とは異なり、電流を使用せずに病変を生切りするcold polypectomyが十二指腸腺腫にも応用されるようになっています。大きさにより一括切除に限界があるため、大きな腺腫であれば分割切除となる場合もありますが、十二指腸壁に熱損傷を与えずに、遺残(取り残し)なく根治性を保ったまま、術後出血などの合併症を減らせるようになってきています。さらに、従来大腸ポリープなどで応用されていた、UEMR(underwater EMR)も取り入れられており、それらの手技は病変の大きさや性状により適切に使い分けられるようになってきています。
前記したように予後、治療成績、合併症などの観点から、大腸腺腫に比べて、十二指腸腺腫/がんは慎重な取り扱いが必要なのですが、大腸腺腫と同様に、癌化に関してのより明確な危険因子が明らかにされ、どの腺腫を切除し、あるいはどの病変が経過観察が許容されるかが解明される必要があります。なぜなら全ての腺腫が癌にprogressionする危険性が高いというわけではないからです。十二指腸腺腫の自然史の解明については、当院院長が過去にAJG誌にて報告しておりますが、今後はより数的・質的に良質な母集団により解析されることが臨床的に必要とされています。
十二指腸腺腫/十二指腸がん②(胃内視鏡/胃カメラ)
十二指腸腺腫/がんは、頻度が少ないものの、大きな腫瘍に関しては発見が特に難しいということはありません。小さな十二指腸腺腫/がんは、十二指腸の部位にもよりますが、隆起型よりも平坦・陥凹型が多いのが特徴で、時に視認性が悪く見逃される場合があります。
十二指腸腺腫/がんは、表面にmilk white mucosa(MWM)と呼ばれる、白色調の粘膜を伴うことが特徴的で、病変におけるMWMの分布や、NBI拡大の内視鏡所見から、ある程度は腺腫かがんか推定することができます(ただしMWMを呈する病変が全て腺腫やがんというわけではありません)。特に、MWMが病変全体に見られる場合には、腺腫である可能性が高くなります。
写真の病変は十二指腸腺腫ですが、病変のほぼ全体にMWMを伴っており、このような病変は生検をせずとも腺腫である可能性が高いと診断できます。

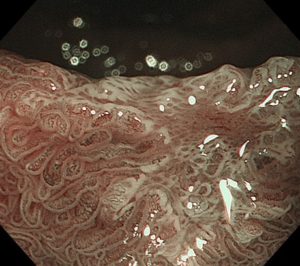
十二指腸腺腫/十二指腸がん①(胃内視鏡/胃カメラ)
十二指腸は、胃と小腸をつなぐ短い臓器で、同部に発生する十二指腸上皮性腫瘍(がん、腺腫)は、内視鏡検査で約0.03~0.5%程度の確率で発見されます(乳頭部腫瘍は除く)。組織型は、大きく腸型、胃型、Brunner 腺腫に分けられますが、腸型の頻度が多いのが特徴です。
十二指腸の上皮性腫瘍は、十二指腸腺腫と十二指腸がんに分けられ、腺腫は良性病変ですが、がんに進展する潜在性を持っています。がん研究会のデータでは20mm以上の大きさの病変や、生検で高異型度腺腫と診断されたものは、進展リスクが高いか、あるいは既に腺腫内がんとなっている可能性が高いことが示されています(Okada et al. Am J Gastoenterol 106:357-64)。
腺腫やがんの治療法は、胃や大腸の腫瘍と同様に、早期のもので転移リスクがないと判断されれば、内視鏡での切除が望ましいところですが、十二指腸は他の臓器に比べて腸管壁が薄い上に、内視鏡の操作性が悪く、胆汁や膵液など切除後潰瘍に影響する消化液が分泌される臓器でもあるため、治療による偶発症がおきやすく、患者さんの状態と各治療の利益/不利益を総合的に考量して治療方針が決められます。
内視鏡治療については、最近、従来のEMRやESDという切除以外に以外にも、腸管壁のダメージが少ない切除法であるコールドポリペクトミーが採用されたり、特殊な器具(OTSC)や人工シートを用いた創閉鎖技術が登場したりしており、少しずつ偶発症に対する克服がなされています。内視鏡治療が難しい場合には、内視鏡・腹腔鏡の合同手術(LECS)を含めた外科手術が考慮されます。
咽頭がん②(胃内視鏡/胃カメラ)
咽頭がんの存在診断は、内視鏡の画像診断と細胞の組織検査により行われますが、深くまで浸潤していることが疑われる場合、腫瘍の広がりの検査をするためにCT、MRI、表在超音波などの検査をし、進展範囲やリンパ節転移の有無を調べていきます。そして、腫瘍の大きさ(T)、頚部リンパ節転移の大きさや数(N)、肺や骨などへの転移(M)などをチェックして、それに応じて、がんの進行度が、第Ⅰ期からⅣ期の4段階に分けられます。通常第Ⅰ期・Ⅱ期を早期がん、第Ⅲ期・Ⅳ期を進行がんと位置付けられています。
がんが比較的限局していて、リンパ節転移がない(もしくはそのリスクが少ないと見積もられる)場合には、比較的侵襲の少ない内視鏡治療(EMR、ESD)のみで治癒切除が期待できます。ただし、状態によっては、放射線治療が選択される場合もあります。
それよりも進行した例では、耳鼻科、頭頸科による手術や放射線化学療法などを組み合わせた治療が選択されます。
咽頭、特に下咽頭は、嚥下(飲み込み)に関わる重要な機能をもっているため、治療に際しては、いかに機能を温存し、生活の質を保つことができるかが重要になってきます。しかし、下咽頭の近くには、発声に関わる喉頭(声帯)も位置しているうえ、見つかったときには進行がんになってしまっている例が圧倒的に多いことから、機能を犠牲にせざるを得ない場合が多いのが現状です。そして、咽頭がんの中で、下咽頭がんが最も予後が悪いとされています。
当院では、5mm程度以下の下咽頭がんの発見に長けており、無症状の段階でそれらを発見する経験と能力を有しております。飲酒、喫煙などの危険因子があり、前記した症状がある方は、上部内視鏡検査をおすすめします。